Em Química um metal, do grego antigo métalon pode ser chamado de várias maneiras: pode ser um elemento, uma substância ou uma liga metálica caracterizado pela sua boa condutividade eléctrica e pelo seu calor, geralmente apresentando uma cor prateada ou amarelada, e uma elevada dureza. Qualquer metal pode ser definido também como um elemento químico que forma aglomerados de átomos com caráter metálico.
Num metal, cada átomo exerce apenas uma fraca atração nos eléctrons mais externos, da camada de valência, que podem então fluir livremente [1] , proporcionando a formação de íons positivos e o estabelecimento de ligações iônicas com não-metais. Os eléctrons de valência são também responsáveis pela alta condutividade dos metais (teoria de bandas).
Os metais são um dos três grupos dos elementos distinguidos por suas propriedades de ionização e de ligação, junto com os metalóides (essa primeira classificação está caindo em desuso, por isso os metalóides foram revisados e alguns foram classificados como metais, e outros como ametais) e os não-metais. A maioria dos metais é quimicamente estável, com a exceção notável dos metais alcalinos e alcalino-terrosos, encontrados nas duas primeiras colunas à esquerda da tabela periódica. Alguns elementos antes classificados como metalóides, hoje são considerados metais, são esses o Germânio, Antimônio e Polônio, os demais são considerados ametais.
Índice
[esconder]Características gerais[editar | editar código-fonte]
Condutibilidade[editar | editar código-fonte]
A condutividade térmica 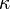 quantifica a habilidade dos materiais de conduzir calor. Materiais com alta condutividade térmica conduzem calor de forma mais rápida que os materiais com baixa condutividade térmica. A condutividade elétrica (
quantifica a habilidade dos materiais de conduzir calor. Materiais com alta condutividade térmica conduzem calor de forma mais rápida que os materiais com baixa condutividade térmica. A condutividade elétrica (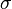 ) é usada para especificar o caráter elétrico de um material. Ela é o recíproco da resistividade. Ela é indicativa da facilidade com a qual um material é capaz de conduzir uma corrente elétrica.
) é usada para especificar o caráter elétrico de um material. Ela é o recíproco da resistividade. Ela é indicativa da facilidade com a qual um material é capaz de conduzir uma corrente elétrica.
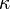 quantifica a habilidade dos materiais de conduzir calor. Materiais com alta condutividade térmica conduzem calor de forma mais rápida que os materiais com baixa condutividade térmica. A condutividade elétrica (
quantifica a habilidade dos materiais de conduzir calor. Materiais com alta condutividade térmica conduzem calor de forma mais rápida que os materiais com baixa condutividade térmica. A condutividade elétrica (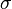 ) é usada para especificar o caráter elétrico de um material. Ela é o recíproco da resistividade. Ela é indicativa da facilidade com a qual um material é capaz de conduzir uma corrente elétrica.
) é usada para especificar o caráter elétrico de um material. Ela é o recíproco da resistividade. Ela é indicativa da facilidade com a qual um material é capaz de conduzir uma corrente elétrica.
Os metais são por natureza bons condutores térmicos e elétricos.[1]
Maleabilidade[editar | editar código-fonte]
A maleabilidade é uma propriedade que junto a ductilidade apresentam os corpos ao serem moldados por deformação. A diferença é que a ductilidade se refere a formação de filamentos e a maleabilidade permite a formação de delgadas lâminas do material sem que este se rompa, tendo em comum que não existe nenhum método para quantificá-los. Em muitos casos, a maleabilidade de uma substância metálica aumenta com a temperatura. Por isso, os metais são trabalhados mais facilmente a quente.
Os metais são fáceis de serem transformados em lâminas.[1]
Elasticidade[editar | editar código-fonte]
Elasticidade estuda o comportamento de corpos materiais que se deformam ao serem submetidos a ações externas (forças devidas ao contato com outros corpos, ação gravitacional agindo sobre sua massa, etc.), retornando à sua forma original quando a ação externa é removida. Até um certo limite ela depende do material e temperatura. A elasticidade linear, entretanto, é uma aproximação; os materiais reais exibem algum grau de comportamento não-linear.
Os metais apresentam alta capacidade de voltar ao normal após serem esticados.
Brilho[editar | editar código-fonte]
O Brilho ou lustre é um termo que descreve o modo como a luz é refletida pela superfície de um mineral, ou qualquer outra superfície polida. A reflectividade de uma substância é dada pela razão entre a quantidade de luz reflectida e a quantidade de luz incidente. Os metais têm brilho, que recebe o nome característico de brilho metálico.[2] [1]
Cristalografia[editar | editar código-fonte]
Os metais apresentam grande diversidade de propriedades físicas e químicas, conforme a pressão, temperatura e outras variáveis, diferentes tipos de mecanismos e estruturas de cristalização, o que também lhe altera as características.
Geralmente, os metais apresentam ordenação cristalina simples, com alto nível de aglutinação atômica (o que implica alta densidade) e numerosos elementos de simetria.[3] No que se refere às combinações, apresentam forte tendência a não formar compostos entre si, mas têm afinidade com elementos não metálicos como o oxigênio e o enxofre, com os quais formam, respectivamente, óxidos e sulfetos.
Metalografia[editar | editar código-fonte]
O tamanho, forma e disposição das partículas metálicas, especificados pela metalografia, são fundamentais para o reconhecimento das propriedades físicas que determinam a plasticidade, resistência à tração,dureza e outras propriedades do material. Esses fatores podem ser alterados por tratamentos térmicos (ciclos de aquecimento resfriamento controlados) ou mecânicos (forjamento, trefilação, laminação, etc.).
Tipos de metais[editar | editar código-fonte]
Os metais quando enumerados alcançam um total de cinquenta e sete elementos químicos, havendo grandes diferenças entre eles como mercúrio (que é líquido) e o sódio (que é leve). Os mais conhecidos e utilizados são o ferro, cobre, estanho, chumbo, ouro e a prata estes dois últimos classificados como metais preciosos.[4]
É comum separar os metais em dois grandes grupos: os ferrosos (compostos por ferro) e os não-ferrosos (aonde o ferro está ausente).[5]
Um outro grupo é composto pelos metais pesados que são metais quimicamente altamente reativos e bioacumuláveis. Como exemplos: cobalto, cobre, manganês, molibdênio,vanádio, estrôncio, e zinco.[6]
A mistura de metais formam as ligas metálicas.
Relação dos metais existentes[editar | editar código-fonte]
Metais alcalinos[editar | editar código-fonte]
Metais alcalino-terrosos[editar | editar código-fonte]
Metais de transição[editar | editar código-fonte]
- Prata (Ag, metal precioso)
- Bório (Bh)
- Cádmio (Cd)
- Cromo (Cr)
- Cobalto (Co)
- Copernicium (Cn)
- Cobre (Cu)
- Darmstácio (Ds)
- Dubnium (Db)
- Ferro (Fe)
- Háfnio (Hf)
- Hássio (Hs)
- Iridio (Ir)
- Manganês (Mn)
- Meitnério (Mt)
- Mercúrio (Hg)
- Molibdênio (Mo)
- Níquel (Ni)
- Nióbio (Nb)
- Ouro (Au, metal precioso)
- Ósmio (Os)
- Paládio (Pd, metal precioso)
- Platina (Pt, metal precioso)
- Rênio (Re)
- Ródio (Rh)
- Roentgenium (Rg)
- Ruténio (Ru)
- Rutherfordium (Rf)
- Escândio (Sc)
- Seabórgio (Sg)
- Tântalo (Ta)
- Tecnécio (Tc)
- Titânio (Ti)
- Tungstênio (W)
- Vanádio (V)
- Ítrio (Y)
- Zinco (Zn)
- Zircônio (Zr)
Outros metais[editar | editar código-fonte]
Referências
- ↑ a b c d Líria Alves. "Metais". Brasil Escola. Consultado em 6 de março de 2012.
- ↑ Pimenta Nunes (20 de setembro de 2007). "Conceito de Metal (Substância Metálica)". knoow.net. Consultado em 6 de março de 2012.
- ↑ Marcelo F. Moreira. "Estrutura cristalina dos metais" (PDF). Consultado em 6 demarço de 2012.
- ↑ Recicloteca. "Tipos de Metal". Consultado em 6 de março de 2012.
- ↑ Ailton. "Metais Ferrosos". Centro Universitário Padre Anchieta, Controle de Processos Químicos. Consultado em 6 de março de 2012.
- ↑ Genilson Pereira Santana (dezembro de 2008). "Elemento-traço ou metal Pesado?". Universidade Federal do Amazonas. Consultado em 6 de março de 2012.
Ver também[editar | editar código-fonte]
Bibliografia[editar | editar código-fonte]
- Karl Otto Henseling: Bronze, Eisen, Stahl. Die Bedeutung der Metalle in der Geschichte. In: Kulturgeschichte der Naturwissenschaften und der Technik. Rowohlt, Reinbek 1981, ISBN 3-499-17706-4 Predefinição:Ge
- Wolfgang Glöckner, Walter Jansen, Rudolf G. Weißenhorn: Handbuch der experimentellen Chemie Sekundarbereich II, Bd.5 : Chemie der Gebrauchsmetalle: Bd. 5. Aulis Verlag Deubner, Köln 2003, ISBN 3-761-42384-5 Predefinição:Ge
Ligações externas[editar | editar código-fonte]
- Metais, Mundo Vestibular.
- Alguns metais não ferrosos, MSPC - Informações Técnicas.
- Metal Pesado, Super Interessante.
- Metais, Departamento de Arquitetura / Universidade Federal de Santa Catarina.
- Quais são os metais mais preciosos que existem?, Marina Motomura.
Metal: história, composição, tipos, produção e reciclagem
Sua HistóriaO primeiro metal descoberto foi o cobre, ainda na pré-história, no oriente médio. Com a descoberta deste material e posteriormente de outros metais foi possível desenvolver ferramentas mais eficientes que as de pedra. Com o uso do metal também foi possível fabricar a roda.
Hoje em dia ele é encontrado em nossa casa (ex: panelas, armários, talheres), nos automóveis, nas embalagens de alimentos, etc.Ele é sólido, não deixa passar luz (é opaco) e conduz bem a eletricidade e o calor, possuindo um brilho especial chamado de metálico. Quando aquecido é maleável, podendo ser moldado em várias formas, desde fios até chapas e barras. Os metais podem ser encontrados misturados no solo e nas rochas, sendo chamados de minérios.ComposiçãoOs minérios são substâncias encontradas em solos e rochas de onde é possível extrair os metais. Alguns metais, tais como o ferro e o cobre, são extraídos dos minérios já na forma a se utilizada. Outros, como o aço e o bronze, precisam ser associados a outras substâncias (ex: aço = ferro + carvão).Tipos de Metal
Existem muitos tipos de metais, chegando hoje ao total de sessenta e oito. Dentre eles existem alguns bem diferentes, como o mercúrio (que é líquido) e o sódio (que é leve). Os mais conhecidos e utilizados há muitos anos são o ferro, cobre, estanho, chumbo, ouro e a prata.Os metais podem ser separados em dois grandes grupos: os ferrosos, compostos por ferro, e os não-ferrosos.Veja abaixo os principais tipos de metais e suas aplicações:TiposAplicaçõesFERROSOS Ferro utensílios domésticos, ferramentas, peças de automóveis estruturas de edifícios, latas de alimentos e bebidas; Aço latas de alimentos, peças de automóveis, aço para a construção civil; NÃO-FERROSOS Alumínio latas de bebidas, esquadrias; Cobre cabos telefônicos e enrolamentos elétricos, encanamentos; Metais pesados Chumbo baterias de carros, lacres; Níquel baterias de celular; Zinco telhados, baterias Mercúrio lâmpadas fluorescentes, baterias AÇOSua HistóriaO ferro foi descoberto ainda na pré-história, porém, o aço, como conhecemos atualmente, só foi desenvolvido em 1856, alcançando grande repercussão no meio industrial. Isso porque o aço é mais resistente que o ferro fundido e pode ser produzido em grandes quantidades, servindo de matéria-prima para muitas indústrias.Com o avanço tecnológico dos fornos e a crescente demanda por produtos feitos de ferro e aço, as indústria siderúrgicas aumentaram a produção. No entanto, o crescimento deste setor trouxe também um aumento da extração de madeira para produção de carvão e da emissão de gases poluentes na atmosfera pela queima de carvão vegetal. Segundo a Worldsteel (associação global do ferro), a produção mundial de aço bruto, em 2014, foi de 1,66 bilhão de toneladas, correspondendo à um crescimento de 1,2% em relação ao ano anterior.O ferro e o aço são encontrados na agricultura (ceifadeiras, colheitadeiras, semeadores, arados, etc.), nos transportes (caminhões, carros, navios, aviões etc.), na construção civil, na indústria automobilística, em embalagens, aparelhos domésticos e muitas outras utilidades.As latas de aço e flandres são amplamente utilizadas no mercado nacional de embalagens principalmente para o armazenamento de alimentos, óleos lubrificantes, tampas metálicas e outros.ComposiçãoPara a obtenção das chapas de aço é necessário extrair da natureza o minério de ferro, denominado hematita, e a partir de sua redução com carvão vegetal, produz-se uma chapa do metal com alto grau de pureza.As latas de aço produzidas com chapas metálicas, conhecidas como folhas de flandres, são compostas por ferro e uma pequena parte de estanho (0,20%) ou cromo (0,007%), materiais que as protegem contra a oxidação (ferrugem).A reciclagem de aço remonta à própria história de utilização do metal. Reciclado, mantém suas propriedades como dureza, resistência e versatilidade. As latas normalmente jogadas no lixo podem retornar a nós em forma de novas latas, ou como vários utensílios – arames, partes de automóvel, dobradiças, maçanetas e muitos outros.Nas áreas de armazenamento, as latas são prensadas para aumentar sua densidade e melhorar as condições de transporte. São enviadas às indústrias siderúrgicas junto com as demais sucatas metálicas, para se transformarem em tarugos ou folhas de flandres.As latas de aço lançadas na natureza sofrem oxidação num prazo médio de 3 anos, transformando-se em óxidos ou hidróxidos de ferro. Se recuperadas, podem ser recicladas infinitamente.








Nenhum comentário:
Postar um comentário