O enxofre (do latim sulphur) é um elemento químico de símbolo S, número atômico 16 e de massa atômica 32 u. À temperatura ambiente, o enxofre encontra-se no estado sólido.
É um não-metal insípido e inodoro,[1] (O famoso "Cheiro de enxofre" vem de seus compostos voláteis, por exemplo o Sulfeto de hidrogênio.)[2] facilmente reconhecido na forma de cristais amarelos que ocorrem em diversos minerais de sulfito e sulfato, ou mesmo em sua forma pura (especialmente em regiõesvulcânicas). O enxofre é um elemento químico essencial para todos os organismos vivos, sendo constituinte importante de muitos aminoácidos. É utilizado emfertilizantes, além de ser constituinte da pólvora, de medicamentos laxantes, de palitos de fósforos e de inseticidas.
Índice
[esconder]Características principais[editar | editar código-fonte]
Este não-metal tem uma coloração amarela, mole, frágil, leve, desprende um odor característico de ovo podre ao misturar-se com o hidrogênio, e arde com chama azulada formando dióxido de enxofre. É insolúvel em água, parcialmente solúvel em álcool etílico, porém se dissolve em dissulfeto de carbono e em toluenoaquecido (cerca de 20g/100mL a 95 °C e menos de 2g/100mL a 20 °C). É multivalente e apresenta como estados de oxidação mais comuns os valores -2, +2, +4 e +6.
Em todos os estados, sólido, líquido e gasoso apresenta formas alotrópicas cujas relações não são completamente conhecidas. As estruturas cristalinas mais comuns são o octaedro ortorrômbico (enxofre α) e o prisma monoclínico ( enxofre β ) sendo a temperatura de transição de 95,5 °C; em ambos os casos o enxofre se encontra formando moléculas na forma de anel. As diferentes disposições destas moléculas é que produzem as diferentes estruturas cristalinas. À temperatura ambiente, a transformação de enxofre monoclínico em ortorrômbico, mais estável, é muito, muito, lenta.
Ao fundir-se o enxofre, obtém-se um líquido que flui com facilidade formado por moléculas de S8 , porém ao aquecê-lo se torna marrom (castanho) levemente avermelhado apresentando um aumento na sua viscosidade. Este comportamento se deve a ruptura dos anéis formando longas cadeias de átomos de enxofre que se enredam entre sí diminuindo a fluidez do líquido; o máximo de viscosidade é alcançado numa temperatura em torno de 200 °C. Esfriando-se rapidamente este líquido viscoso obtém-se uma massa elástica, de consistência similar a da goma, denominada enxofre plástico ( enxofre γ ) formada por cadeias que não tiveram tempo para reorganizarem em moléculas de S8; após certo tempo a massa perde a sua elasticidade cristalizando-se no sistema rômbico. Estudos realizados comraios X mostram que esta forma amorfa pode estar constituída por moléculas de S8 com uma estrutura de hélice em espiral.
No estado de vapor também forma moléculas de S8, porém a a 780 °C já se alcança um equilíbrio com moléculas diatômicas, S2, é acima de aproximadamente 1800 °C a dissociação se completa encontrando-se átomos de enxofre.
Aplicações[editar | editar código-fonte]
O enxofre é usado em múltiplos processos industriais como, por exemplo, na produção de ácido sulfúrico para baterias, fabricação de pólvora e vulcanização daborracha. O enxofre também tem usos como fungicida e na manufactura de fosfatos fertilizantes. Os sulfitos são usados para branquear o papel e como conservantes em bebidas alcoólicas. O tiossulfato de sódio é utilizado em fotografia como fixador já que dissolve o brometo de prata; e o sulfato de magnésio (sal Epsom) tem usos diversos como laxante, esfoliante ou suplemento nutritivo para plantas e na produção de sulfureto de hidrogénio (ácido sulfídrico). O enxofre, após ser oxidado num forno formando o gás sulfito, é utilizado na clarificação do caldo de cana-de-açúcar, numa das etapas para obtenção do açúcar refinado.
Papel biológico[editar | editar código-fonte]
Os aminoácidos cisteína, metionina homocisteína e taurina contém enxofre, formando as pontes de dissulfeto entre os polipeptídeos, ligação de grande importância para a formação das estruturas espaciais das proteínas, o que caracteriza o enxofre um dos elementos CHONPS (os seis elementos fundamentais para a vida na Terra). É constituinte de algumas vitaminas, participando na síntese do colágeno (colagénio), neutraliza os tóxicos e ajuda o fígado na secreção da bílis. É encontrado em legumes como aspargos, alhos-poró, alhos, cebolas, também em pescados, queijos e gema de ovos; diferentemente do inorgânico, o enxofre dos alimentos não é tóxico e seu excesso é eliminado pela urina. Sua deficiência retarda o crescimento.[carece de fontes]
As plantas absorvem o enxofre do solo como íon sulfato, e algumas bactérias utilizam o sulfeto de hidrogênio da água como doadores de elétrons num processo similar a uma fotossíntese primitiva.
Mais informações: ciclo do enxofre
História[editar | editar código-fonte]
O enxofre é conhecido desde a antiguidade. No século IX a.C. Homero já recomendava evitar a pestilência do enxofre.
Aproximadamente no século XII, os chineses inventaram a pólvora, uma mistura explosiva de nitrato de potássio ( KNO3 ), carbono e enxofre.
Os alquimistas na Idade Média conheciam a possibilidade de combinar o enxofre com o mercúrio.
Somente nos finais da década de 1770 a comunidade científica convenceu-se, através de Antoine Lavoisier, de que o enxofre era um elemento químico e não um composto.
Abundância e obtenção[editar | editar código-fonte]
O enxofre é o 16º elemento em ordem de abundância, constituindo 0,034% em peso na crosta terrestre, é encontrado em grandes quantidades na forma de sulfetos (galena) e de sulfatos (gesso). Na forma nativa é encontrado junto a fontes termais, zonas vulcânicas e em minas de cinábrio, galena, esfalerita e estibina. É extraído pelo processo Frasch, processo responsável por 23% da produção, que consiste em injetar vapor de água superaquecido para fundir o enxofre, que posteriormente é bombeado para o exterior utilizando-se ar comprimido.
Também está presente, em pequenas quantidades, em combustíveis fósseis como carvão e petróleo, cuja combustão produz dióxido de enxofre que combinado a água resulta na chuva ácida, por isso, a legislação de alguns países exige a redução do conteúdo de enxofre nos combustíveis. Este enxofre, depois de refinado, constitui um porcentual importante do total produzido mundialmente. Também é extraído do gás natural que contém sulfeto de hidrogênio que, uma vez separado, é queimado para a produção do enxofre:
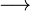 2 S + 2 H2O
2 S + 2 H2O
A coloração variada de Io, a lua vulcânica de Júpiter se deve a presença de diferentes formas de enxofre no estado líquido, sólido e gasoso. O enxofre também é encontrado em vários tipos de meteoritos e, acredita-se que a mancha escura que se observa próximo a cratera lunar Aristarco deva ser um depósito de enxofre.
Compostos[editar | editar código-fonte]
Muitos dos odores desagradáveis da matéria orgânica se devem a compostos de carbono que contém o enxofre na forma de sulfeto de hidrogênio. Dissolvido em água e ácido ( pKa1 = 7,00, pKa2 = 12,92 ) ele reage com os metais. Os sulfetos metálicos se encontram na natureza, sobretudo o de ferro( pirita ) que pode apresentar resistência negativa e a galena, sulfeto de chumbo natural, na qual se observou pela primeira vez o efeito semicondutor retificado.
O nitreto de enxofre polímero (SN)x, sintetizado em 1975 por Alan G. MacDiarmid e Alan J. Heeger, apresenta propriedades metálicas, apesar de ser constituído por não metais com propriedades elétricas e ópticas não usuais. Este trabalho serviu de base para o posterior desenvolvimento, com Hideki Shirakawa, de plásticos condutores e semicondutores que motivou a concessão do Prêmio Nobel de Química, em 2000, aos três pesquisadores.
Os óxidos mais importantes são o dióxido de enxofre, SO2 que em água forma uma solução de ácido sulfuroso, e o trióxido de enxofre, SO3, que em solução forma o ácido sulfúrico; sendo os sulfitos e sulfatos ossais respectivos.
O enxofre, com o oxigênio e o hidrogênio, forma diversos outros ácidos, como o tiossulfúrico, que dá os tiossulfatos e hipossulfuroso que dá os hipossulfitos (no exato do termo).
Isótopos[editar | editar código-fonte]
São conhecidos 18 isótopos do enxofre, quatro dos quais são estáveis: S-32 (95,02%), S-33 (0,75%), S-34 (4,21%) e S-36 (0,02%). O S-35, formado a partir da incidência da radiação cósmica sobre o Argônio-40 atmosférico tem uma vida média de 87 dias; os demais isótopos radiativos são de vida curta.
Precauções[editar | editar código-fonte]
O dissulfeto de carbono, o sulfeto de hidrogénio, e o dióxido de enxofre devem ser manuseados com cautela. Além de ser bastante tóxico (mais que o cianureto), o dióxido de enxofre reage com a água da atmosfera produzindo a chuva ácida, e em altas concentrações reage com a água dos pulmões formando ácido sulfuroso que provoca hemorragias, enchendo os pulmões de sangue com a consequente asfixia. O sulfeto de hidrogénio é muito fétido, mesmo em baixas concentrações. Quando a concentração aumenta o sentido do olfato rapidamente se satura desaparecendo o odor, passando despercebida a sua presença no ar, deixando as vitimas expostas aos seus efeitos, possivelmente letais, caso seja o único gás presente no local.
Referências
Bibliografia[editar | editar código-fonte]
- LIDE, David R. (ed.), TAYLOR and FRANCIS. CRC Handbook of Chemistry and Physics. 87.ed. Boca Raton, FL.
Ligações externas[editar | editar código-fonte]
- Enciclopedia Libre
- Los Alamos National Laboratory - azufre
- WebElements.com - azufre
- EnvironmentalChemistry.com - azufre
Enxofre é uma substância amarela encontrada no solo, que queima com facilidade. Ele entra na produção de ácido sulfúrico, uma substância muito utilizada para fertilizantes, corantes e explosivos (pólvora, palitos de fósforo, etc). O enxofre é encontrado nas rochas sedimentares, (formadas por depósitos que se acumularam pela ação da natureza) nas rochas vulcânicas, no carvão , no gás natural etc.
O enxofre é essencial para a vida, faz parte da moléculas de proteína, vitais para o nosso corpo. Cerca de 140g de enxofre estão presentes no ser humano. A natureza recicla enxofre sempre que um animal ou planta morre. Quando apodrecem, as substâncias chamadas de “sulfatos”, combinados com a água são absorvidos pelas raízes das plantas. Os animais o obtêm comendo vegetais ou comendo outros animais.
Quando o ciclo é alterado, animais e plantas sofrem, isso vem acontecendo através da constante queima de carvão, petróleo e gás. Esses combustíveis são chamados de “fósseis”, pois se formaram há milhões de anos, a partir da morte de imensas florestas tropicais ou da morte de microscópicas criaturas denominadas “plânctons”.
Chuva Ácida
Ao queimar combustíveis fósseis para acionar as usinas, fábricas e veículos, é lançado enxofre no ar. Esse enxofre sobe para a atmosfera na forma de gás chamado “dióxido de enxofre”, um grande poluente do ar. Quando o dióxido de enxofre se junta à umidade da atmosfera, forma o ácido sulfúrico, um dos principais componentes das chuvas ácidas.
O dióxido de enxofre é produzido também nos pântanos e vulcões, mas em quantidades que o meio ambiente consegue assimilar. Atualmente existem enormes quantidades de fontes poluidoras, tornando as chuvas mais carregadas de ácido, dificultando ao meio ambiente anular seus efeitos. A chuva causa danos às folhas de espécies vegetais comprometendo a produção agrícola. Torna-se mais grave próxima às grandes concentrações industriais, atinge as florestas, os peixes e corroe edificações de pedra e concreto, inclusive metais expostos ao tempo que enferrujam mais rápido, como as pontes e edificações de aço.
Nenhum comentário:
Postar um comentário